Bardzo często mówi się o tym, że szczepionki na COVID-19 są „w fazie badań”. Tego typu informacja może być zarówno prawdziwa jak i stanowić manipulację: zależy to od kontekstu jej wypowiedzenia.
Czym właściwie są wspomniane „badania”?
Chodzi o badania kliniczne, których definicję przytacza Amerykańska Agencja Żywności i Leków: “Badania kliniczne to dobrowolne badania naukowe prowadzone na ludziach i mające na celu udzielenie odpowiedzi na konkretne pytania dotyczące bezpieczeństwa lub skuteczności leków, szczepionek, innych terapii lub nowych sposobów wykorzystania istniejących metod leczenia.”
Badania kliniczne testujące nowe metody leczenia są podzielone na różne etapy, zwane fazami. Badania w najwcześniejszej fazie mogą sprawdzać, czy dany lek jest bezpieczny lub jakie skutki uboczne wywołuje. Badania w późniejszych fazach mają na celu sprawdzenie, czy nowa terapia jest lepsza od istniejących metod leczenia. Każda faza musi zakończyć się wynikiem pozytywnym, aby można było przejść do kolejnej.
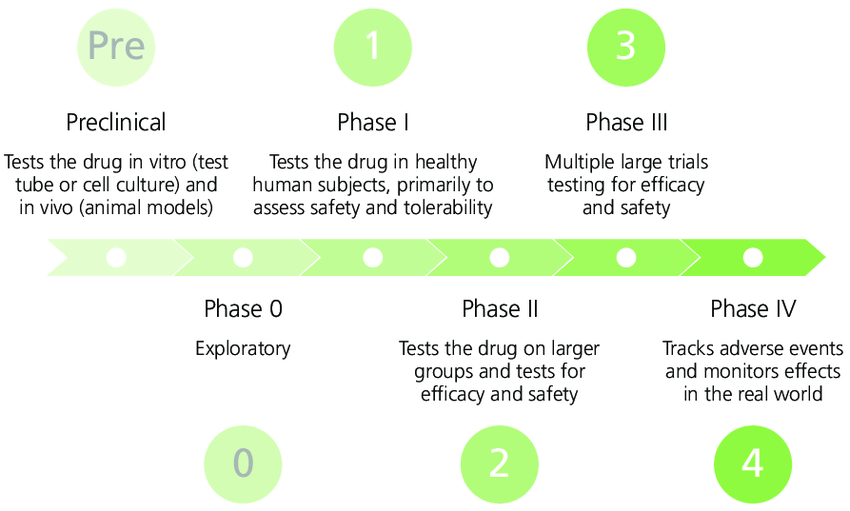
Badania kliniczne dzielą się na IV zasadnicze fazy, wskazuje się też na fazy poprzedzające pierwszą fazę badań klinicznych: fazę przedkliniczną i fazę 0.
- Faza przedkliniczna polega na zbadaniu podstawowych danych dotyczących skuteczności, toksyczności, farmakokinetyki i bezpieczeństwa. Głównym celem badań przedklinicznych jest określenie bezpiecznej dawki początkowej do badań na ludziach oraz ocena potencjalnej toksyczności produktu. Dawki leku testuje się za pomocą doświadczeń in vitro (w probówkach lub hodowlach komórkowych) oraz in vivo (na zwierzętach). Podobnie jak w przypadku badań klinicznych, istnieją pewne rodzaje badań, które muszą być wykonane w większości przypadków (badania toksykologiczne) oraz inne badania, które są specyficzne dla danego związku lub pytania badawczego
- Faza 0 badania klinicznego jest przeprowadzana na bardzo małej liczbie osób, zwykle mniejszej niż 15. Badacze stosują bardzo małą dawkę leku, aby upewnić się, że nie jest on szkodliwy dla ludzi, zanim zaczną go stosować w większych dawkach w późniejszych fazach.
- Podczas badań fazy I bada się zwykle nowe leki po raz pierwszy na małej grupie osób, aby ocenić bezpieczny zakres dawek i zidentyfikować działania niepożądane. Badania fazy I mają na celu ustalenie: jaka dawka leku jest bezpieczna do podania, jakie są skutki uboczne czy jak organizm pozbywa się leku. W pierwszej kolejności wstępnie oceniane jest bezpieczeństwo badanej substancji. W grupie kilkudziesięciu zdrowych ochotników bada się metabolizm, wchłanianie, wydalanie, ewentualną toksyczność oraz interakcje z innymi przyjmowanymi substancjami (pokarmami, lekami). Po zakończeniu tego etapu możliwe jest określenie dawkowania badanej substancji. Oprócz oceny bezpieczeństwa i dawkowania, badacze zwracają również uwagę na najlepszy sposób podawania leku, np. doustnie, dożylnie lub miejscowo. Około 70 procent leków przechodzi do fazy II.
- Podczas badań fazy II testuje się terapie, które zostały uznane za bezpieczne w fazie I, ale teraz potrzebują większej grupy ludzi, aby monitorować ewentualne działania niepożądane. Badania fazy II mają na celu ustalenie: czy nowa metoda leczenia działa wystarczająco dobrze, aby można ją było przetestować w większym badaniu fazy III. Podczas tej fazy dowiadujemy się więcej na temat skutków ubocznych i sposobów radzenia sobie z nimi, więcej na temat najlepszej dawki, jaką należy stosować. Szczegółowej ocenie w II fazie podlegają dane dotyczące wchłaniania, metabolizmu i wydalania leku w zależności od płci i wieku. Na tym etapie badań dochodzi do porównywania działania nowego leku oraz placebo, lub leku stosowanego w leczeniu danej choroby. Do porównania dochodzi na gruncie metody ślepej próby, która ma zapewnić możliwie najbardziej obiektywną ocenę działania. Znaczy to tyle, że ani pacjent, ani badacz nie wiedzą, czy choremu podawana jest substancja będąca przedmiotem badania, czy też placebo. Grupa biorąca udział w tym badaniu jest dobrana losowo i obejmuje kilkuset ochotników – w tym przypadków pacjentów, chorujących na daną chorobę. Pozytywna ocena II fazy badań jest uzyskiwana, gdy stosunek korzyści do ryzyka wynikających ze stosowania substancji jest wyraźnie większy.
Do etapu trzeciego przechodzi około 33% preparatów.
- Badania fazy III są prowadzone na większych populacjach oraz w różnych regionach i krajach i są etapem bezpośrednio poprzedzającym zatwierdzenie nowego leczenia. Celem fazy III jest ocena działania nowego leku w porównaniu z istniejącymi lekami stosowanymi w tym samym schorzeniu. Aby móc kontynuować badania, badacze muszą wykazać, że lek jest co najmniej tak samo bezpieczny i skuteczny jak istniejące opcje leczenia. Faza III badań klinicznych ma na celu ostateczne potwierdzenie skuteczności badanej substancji w leczeniu danej choroby. Etap ten obejmuje badania związku pomiędzy bezpieczeństwem leku a jego skutecznością podczas krótkotrwałego oraz długotrwałego stosowania. Podobnie jak w badaniach fazy II stosuje się tu tzwn. podwójną ślepą próbę i losowy dobór pacjentów.
Do badań fazy IV przechodzi około 25-30% medykamentów.
- Badania fazy IV odbywają się po zatwierdzeniu leku po zatwierdzeniu leku przez instytucję-regulatora (np. FDA, EMA) w danym kraju lub regionie i istnieje potrzeba dalszych badań w szerokiej populacji w dłuższym okresie czasu. Faza IV przeprowadzana jest na wielu tysiącach uczestników i trwa zwykle wiele lat. Badacze wykorzystują tę fazę, aby uzyskać więcej informacji na temat długoterminowego bezpieczeństwa leku, jego skuteczności, działań niepożądanych oraz wszelkich innych korzyści i ryzyka płynących z jego zażycia.
Źródło grafiki: https://www.researchgate.net/figure/The-phases-of-clinical-trial-research-Clinical-trials-pass-through-a-series-of-phases-as_fig2_340365409
Uczestnictwo w badaniu zakłada wykonanie przez badacza jak i badanego kolejno wielu aktywności:
- Wyjaśnienie uczestnikowi badania, a następnie zebranie od niego dodatkowych informacji.
- Uzyskanie formularza zgody podpisanego przez uczestnika.
- Badanie przesiewowe i sprawdzenie, czy uczestnik kwalifikuje się do badania.
- Po dokonaniu selekcji, uczestnik jest umawiany na wizytę wyjściową (pierwsza wizyta). Tutaj przeprowadzane są testy fizyczne i poznawcze.
- Kolejnym krokiem jest umieszczenie uczestnika w grupie kontrolnej.
- Wszelkie problemy lub efekty uboczne, z którymi boryka się uczestnik, powinny być zgłaszane badaczom.
- Regularnie zaplanowane wizyty uczestników w ośrodku badawczym, aby badacz mógł ocenić stan fizyczny, poznawczy oraz efekty uboczne leczenia.
Wszystkie dostępne na europejskim rynku (zaakceptowane przez Europejską Agencję Leków) szczepionki opublikowały już wyniki fazy III badań klinicznych.
Johnson&Johnson- kwiecień 2021
Trwają badania fazy IV nad szczepionkami przeciw COVID-19. Jest to normalny element procedury wykorzystywany przy innych preparatach medycznych w tym lekach. Preparat, który przeszedł III fazę badania klinicznego charakteryzuje się dwiema kluczowymi cechami: jest bezpieczny i skuteczny. To sprawia, że organy regulujące dostęp preparatów do rynku zezwalają na ich rozpowszechnianie.
Kacper Nowina-Konopka
Bibliografia:
https://www.who.int/health-topics/clinical-trials#tab=tab_
https://pubrica.com/academy/statistical/on-biostatistics-and-clinical-trials/
https://www.qualio.com/blog/phases-of-clinical-trials
https://www.cdc.gov/vaccines/basics/test-approve.html
https://www.ema.europa.eu/en/human-regulatory/research-development/clinical-trials-human-medicines
https://www.healthline.com/health/clinical-trial-phases#phase-0
https://www.profil.com/knowledge-center/trial-stages
https://www.fda.gov/patients/drug-development-process/step-3-clinical-research






